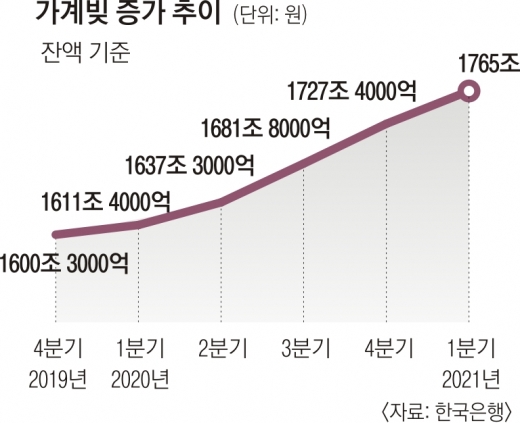
HLB(에이치엘비)가 간암 신약 FDA 승인을 위해 고군분투하고 있다.
25일 오전 11시 40분 기준 HLB는 전 거래일 대비 1.11% 오른 5만 100원에 거래되고 있다.
HLB의 간암 치료 신약 '리보세라닙-캄렐리주맙 병용요법'의 미국 식품의약국(FDA) 품목허가를 위한 세 번째 도전이 본격화됐다.
23일 HLB 공식 블로그에 따르면, HLB의 미국 자회사 엘레바와 중국 파트너사 항서제약은 지난 18일 FDA와의 미팅에서 품목허가 재신청 관련 사안을 논의했다.
HLB는 FDA가 이전 보완사항에 대해 이견이 없으며, 추가 자료 제출을 요청했다고 밝혔다. 항서제약은 빠르게 데이터를 확보하여 재신청에 나설 계획이지만, 재신청 일정과 세부 내용은 아직 공개되지 않았다.
HLB 관계자는 항서제약 제조시설 관련 사안으로 협의가 필요하다며 추후 공지하겠다고 전했다.
앞서 HLB는 지난 18일(현지시각) 미국 식품의약국(FDA)과 간암 표적항암제 '리보세라닙'과 중국 항서제약의 면역관문 억제제 '캄렐리주맙' 병용요법 신약 품목허가 신청과 관련한 타입-A(Type-A) 미팅을 성공적으로 마쳤다고 전날 밝혔다.
HLB는 이날 공식 블로그 공지사항을 통해 "이번 미팅은 항서제약이 FDA의 지적사항을 보완한 후 제출한 내용이 FDA의 견해에 부합하는지를 듣고자 하는 것이었다"고 설명했다.
미팅 결과, FDA는 보완사항에 대해 별다른 이견이 없었으며, 보완한 내용을 기반으로 한 추가 자료를 제출해달라고 요청했다.
이에 따라 항서제약은 FDA가 요청한 추가 자료 데이터를 신속하게 확보한 후 간암 신약에 대한 재신청을 진행할 예정이다.
HLB는 앞서 두 차례 FDA로부터 보완요구서한(CRL)을 수령한 바 있으며, 특히 항서제약의 제조·품질관리(CMC) 지적사항이 승인 보류의 주요 원인으로 지목되어 왔다